Gruß chemweazle,
Zur
Reaktion von 2-Chlorproponsäure mit Natriumhydroxid-Lösung nach SN1 oder SN2?
Hallo, kann mir jemand bitte sagen, ob die Reaktion von 2-Chlorproponsäure mit Natriumhydroxid-Lösung nach SN1 oder SN2 reagiert? Es entsteht als Produkt übrigens Milchsäure (2-Hydroxyproponsäure) und NaCl.
Ich weiß, dass es sich um eine nucleophile Substitution handelt und vermute, dass es nach SN1 abläuft, weil:
-Cl- eine gute Abgangsgruppe ist
na, ja, wenn sie durch das Lösungsmittel gur solvatisiert wird, oder aus dem Gleichgewicht entfernt werden kann
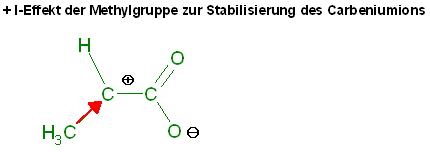
- Das Carbeniumion durch den +I Effekt der Methylgruppe stabilisiert wird
ein guter Aspekt, der schon für den SN1-Mechanismus spricht, die Stabilisierung des Carbeniumions
Skizze
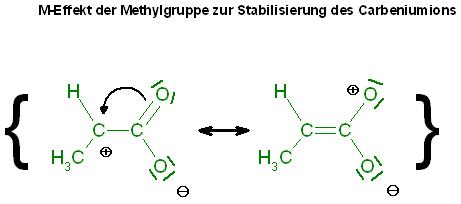
- Mesomeriestabilisierung durch die COOH Gruppe (Umklappen der Dobi??)
Genau, dieser +M-Effekt ist oft stärker, als die Stabilisierung des Carbeniumions nur durch den postiven Induktiven Effekt
Allerdings müßte man nicht mehr von der COOH-Gruppe, sondern von der Carboxylat-Gruppe reden. (COO(-))
Denn im 1ten Schritt reagiert 1 Equivalent NaOH mit der Carbonsäure zum entsprechendem Natriumsalz.
Diese Säure-Base-Reaktion ist nun mal die allerschnellste Reaktion von allen hier diskutierten Reaktionen
CH3-CH(-Cl)-CO2Hsolv + NaOHsolv → CH3-CH(-Cl)-CO2⊖solv + Na⊕solv + H2O
Skizze
Das sind wirklich Aspekte, die für den dissoziativen Austausch, der monomolekularen Substitution, SN1, sprechen.
Für beide Reaktanden braucht man polare Lösungsmittel. Polare Lösungsmittel begünstigen oft einen SN1-Reaktionsverlauf.
Dazu muß das Lösungsmittelgemisch ziemlich polar sein, um auch das Natriumhydroxid zu lösen und das Chloridion, die Abgangsgruppe, das Nucleofug, zu solvatisieren. Dazu soll auch das im ersten, langsamsten Schritt, die Dissoziation der C-Cl-Bindung, enstandene Carbeniumion solvatisiert werden.
Mit den passenden Lösungsmitteln kann man sicherlich die SN1-Route begünstigt ablaufen lassen.
In typisch unpolaren Lösemitteln ist die SN2-Reaktion begünstigt.
Aber einer der beiden Ausgangsstoffe, das NaOH, löst sich nur polaren Lösemitteln.
Aber mal grundsätzlich können auch beide Reaktonsmechanismen nebeneinander ablaufen.
Die dominierende Reaktion ist die am schnellsten abläuft.
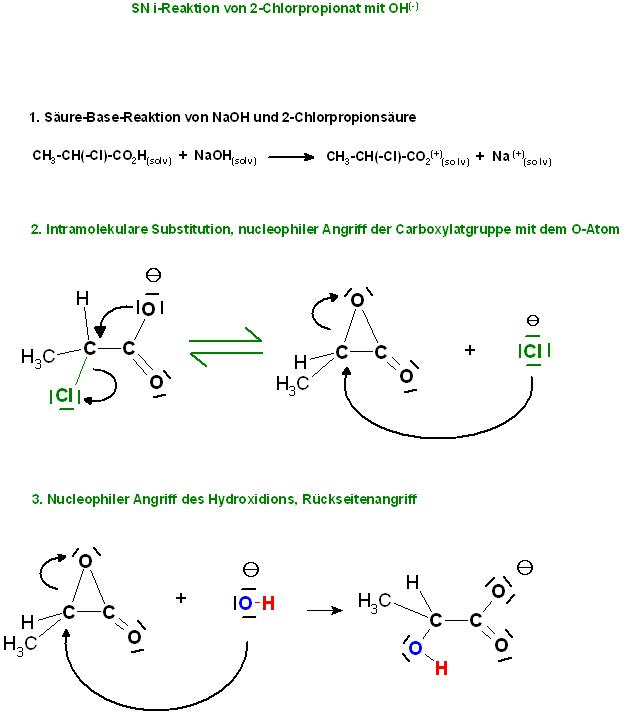
Es gibt sogar noch einen 3. Mechanismus, das ist die intramolekulare, nucleophile Substitution, die SNi-Reaktion. Diese intramolekulare Nucleophile Substitution läuft immer dann ab, wenn nucleophile Nachbargruppen im Molekül vorhanden sind. In diesem Beispiel wäre die Nucleophile Nachbar-Gruppe das Carboxylation-Fragment.
Die Hauptreaktions-Route müßte die SN1-Reaktion sein. Denn es wird NaOH als Nucleophil-Lieferant eingesetzt. Es muß ein sehr polares Lösungsmittel verwendet werden.
Vielleicht läuft noch die SNi-Reaktion parallel zur SN1-Route, denn es liegt eine nucleophile Nachbargruppe vor, das Carboxylation-Fragment.
Gesamtreaktion
CH3-CH(-Cl)-CO2Hsolv + 2 NaOHsolv → CH3-CH(-OH)-CO2Nasolv + Na-Clsolv + H2O
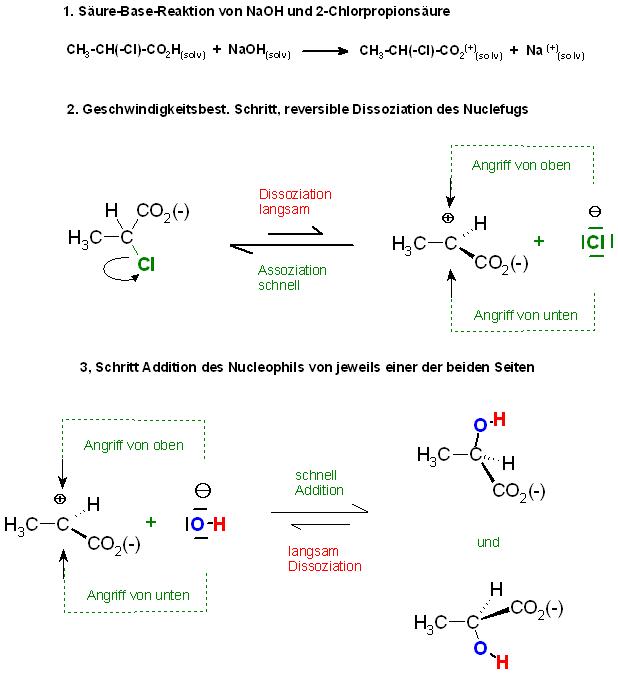
1. Teilreaktion die Säure-Base-Reaktion, 2-Chlorpropansäure mit NaOH
CH3-CH(-Cl)-CO2Hsolv + NaOHsolv → CH3-CH(-Cl)-CO2⊖solv + Na⊕solv
2. Teilreaktion, Dissoziation der C-Cl-Bindung, Bildung der solvatisierten Carbeniumionen und solvatisierten Chloridionen, der langsamste Teilschritt, der geschwindigkeitsbest. Schritt
CH3-CH(-Cl)-CO2⊖solv ⇌ CH3-CH(⊕)-CO2⊖solv + -Cl⊖solv
Die Dissoziationsreaktion ist umkehrbar, reversibel. Die Hinreaktion ist die Dissoziation der Chloridionen, Abgangsgruppen, Nucleofug unter Bildung der solvatisierten Carbeniumionen und der solvatisierten Chloridionen.
Die Rückreaktion ist die Assoziation der Carbeniumionen mit den Chloridionen.
Diese Rückreaktion, Assoziation, hat oft größrer Geschwindigkeits-Proportionalität-Konstanten, als die Hinreaktion.
Am langsamsten Dissoziationsschritt ist nur 1 Sorte von Teilchen beteiligt, hier im Beispiel das2-Chlor-propionat. Deshalb die Molekularität 1, Substitution, nucleophil, monomolekular, SN1.
3. Teilreaktion, Einfang des Nucleophils, Eintrittsgruppe durch das Carbeniumion, schneller, als die Dissoziation der C-Cl-Bindung
CH3-CH(⊕)-CO2⊖solv + OH⊖solv → CH3-CH(OH)-CO2⊖solv
Skizze zum Mechanismus der SN1- Route
Zur Ergänzung die Intramolekulare Nucleophile Substitution, Mechanismus
Skizze