Grüße chemweazle,
Zur
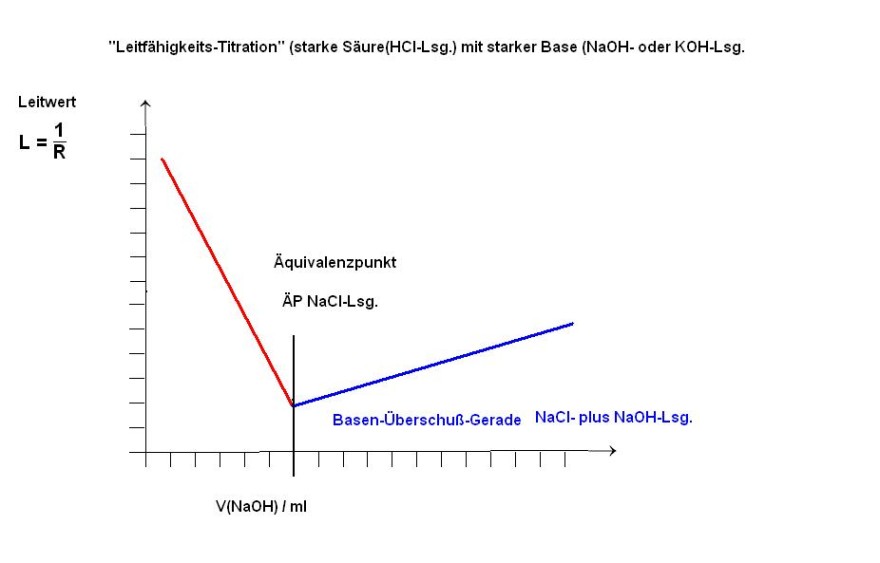
"Leitfähigkeits-Titration" starke Säure(verd. HCl-Lsg.) mit starker Base( NaOH- oder KOH-Lsg.)
Betrachtungen zur elektrischen Leitfähigkeits-Änderung während der Titration auf Teilchebene
Elektrolytische Leitfähigkeit L
Die Leitfähigkeit, der Leitwert, reziproker Widerstand, [ L = 1⁄R ] eines Elektrolyten, bestehend aus Anionen und Kationen ist einerseits proportional der Konzentration der Anionen und Kationen und deren Wanderungsgeschwindigkeit bei gegebener elektrischen Feldstärke(E = U / l ).
Die Wanderungsgeschwindigkeit der Anionen in Richtung Anode und der Kationen in Richtung Katode hängt einmal von der Teilchensorte ab und andererseits ist diese proportional zum elektrischen Feld, E =U / l.
Die Wanderungsgeschwindigkeit, v, bezogen auf die elektrische Feldstärke, E, heißt Beweglichkeit, u, des betreffenden Anions bzw, Kations.
$$u(Kation) = \dfrac{v(Kation)}{E}$$
$$u(Anion) = \dfrac{v(Anion)}{E}$$
Beweglichkeiten der ionen abhängig von Ihrer Sorte
Die Schnellsten Wanderer(Ionen) von (Ion = Wanderer, griechisch) sind die H(+)-Ionen, die allerschnellsten und die zweitschnellsten die Hydroxidionen(OH(-)).
Diese beiden Ionensorten bewegen sich besonders schnell, ein Modell zur Erklärung Ihrer hohen Beweglichkeit ist der Grotthus-Mechanismus. ("Eimerketten-Mechanismus")
Die mittelschnellen Ionen, die mittelbeweglichen Ionen
Kationen: Na(+) und K(+) Anionen : Cl(-) und NO3(-)
Titration der starken Säure(HCl-Lsg.) mit NaOH- oder KOH-Maßlösung
Vor der Zugabe der Base liegt die verd. HCl-Lsg vor mit den schnellsten Ionen, den Hydronium-Ionen und den mittelschnellen Chlorid-Ionen. Die Leitfähigkeit hat Ihr Maximum in der Diagramm-Skizze.(Anfangspunkt der roten fallenden Geraden)
Im Intervall bis einschließlich dem ÄP nimmt der Leitwert linear ab, rote fallende Gerade in der Skizze.
Während der Zugabe von Hydroxidionen werden zunehmend die schnellsten H(+)-Ionen durch die Säure-Base-Reaktion mit den zugegebenen Hydroxidionen verbraucht und jedes verbrauchte schnelle hydroniumion wird dabei durch ein langsameres, nur mittelschnelles, Natrium-Ion oder Kalium-Ion ersetzt.
H(+)(aq)(schnell) + Cl(-)(aq)(mittelschnell) + OH(-)(aq)(schnell) + Na(+)(aq)(mittelschnell) → H2O + Na(+)(aq)(mittelschnell) + Cl(-)(aq)(mittelschnell)
Deshalb nimmt die Elektrische Leitfähigkeit ( Leitwert ) linear ab bis hin zum Äquivalenzpunkt.
Am ÄP (Äquivalenzpunkt) liegt eine reine NaCl-Lsg. bzw. KCl-Lsg vor.
Am ÄP ist die Elektrische Leitfähigkeit der titrierten Lösung minimal.
Die schnellen H(+)-Ionen sind vollständig verbraucht und durch die mittelschnellen Kationen, Natrium- oder Kaliumionen, ersetzt.
Durch die Zugabe an Maßlösung tritt ein Mischvolumen und somit ein Verdünnungs-Effekt auf, der auch für die Abnahme der Leitfähigkeit sorgt.
Überschuß-Gerade
Durch die Zugabe an überschüssiger Maßlösung steigt die Hydroxidionen-Konzentration an und somit steigt auch der Leitwert wieder linear an.
Allerdings ist der Anstieg (Steigung) der Basen-Überschußgeraden nicht so steil wie bei der roten Geraden.
Skizze
Die Beweglichkeit der OH(-)-Ionen ist geringer als die der H(+)-Ionen.
Skizze