Grüße chemweazle,
Zur LFSE oktaedrischer Komplexe low- und high-spin mit 4 Elektronen
Zu den oktaedrischen Komplexen von V(+), einmal high-spin im schwachen Ligandenfeld bei geringer Aufspaltung, kleinen Δo und der oktaedrische Low-spin-Komplex bei starken Ligandenfeld, großes Δo, größer als die Elektronenpaarungs-Energie
Elektronenkonfigurationen des V(I)-Kations
Nach dem Aufbauprinzip hätte ein einzelnes V-Atom im Metalldampf die folgende Konfiguration, mit doppelt besetzter 4s-Schale
Elektronenkonfiguration: 3d3 4s2
Ein Vanadium(I)-Kation mit einem Elektron weniger hätte nach dem Aufbauprinzip folgende Elektronenkonfiguration:
Elektronenkonfiguration: 3d3 4s1
Für oktaedrische Komplexe macht man die 4s-Schale frei und steckt die 4s-Elektronen in die 3d-Schale.
Das leere 4s-Orbital wird mit 3 leeren 4p-Orbitalen und 2 leeren 4d-Orbitalen hybridisiert zu 4sp3d2-Hybrid-Orbitalen. Diese leeren Hybridorbitale überlappen mit den Orbitalen der vormals freien Elektronenpaare der 6 Liganden.
Elektronenkonfiguration des V(I)-Kations nach der Ümfüllung der 4s-Elektronen in die 3d-Schale
Elektronenkonfiguration: 3d4 4s0
3d4
Kristallfeld, Ligandenfeld
Spärisches, Kugellschalenfförmiges Ligandenfeld
Bei einem gedachten kugelförmigen Ligandenfeld mit einer kugelschalenartigen Elektronenverteilung der 6 mal 2 Elektronen(!2 Elektronen) um die 3d-Schale des Zentral-Metall-Ions werden die fünf 3d-Orbitale energetisch durch die Elektrostatische Abstoßungs-Energie gleichermaßen angehoben.
(siehe Skizze), siehe Wikipedia unter Ligandenfeld
Oktaedrisches Ligandenfeld
Bei Oktaedrischer Koordination von 6 Elektronenpaaren um die 3d-Schale des Zentralions werden 2 der fünf 3d-Orbitale um 2 Fünftel der Oktaedrischen Aufspaltungs-Energie im Vergleich zur Energetischen Anhebung bei Kugelförmiger Koordination der Ladungen angehoben. ( 2⁄5 Δo )
3 der Fünf 3d-Orbitale werden um drei Fünftel der Aufspaltungsenergie im Oktaedrischen Feld abgesenktim Vergleich zur Energetischen Anhebung im Spärischen Ligandenfeld.
( - 3⁄5 Δo )
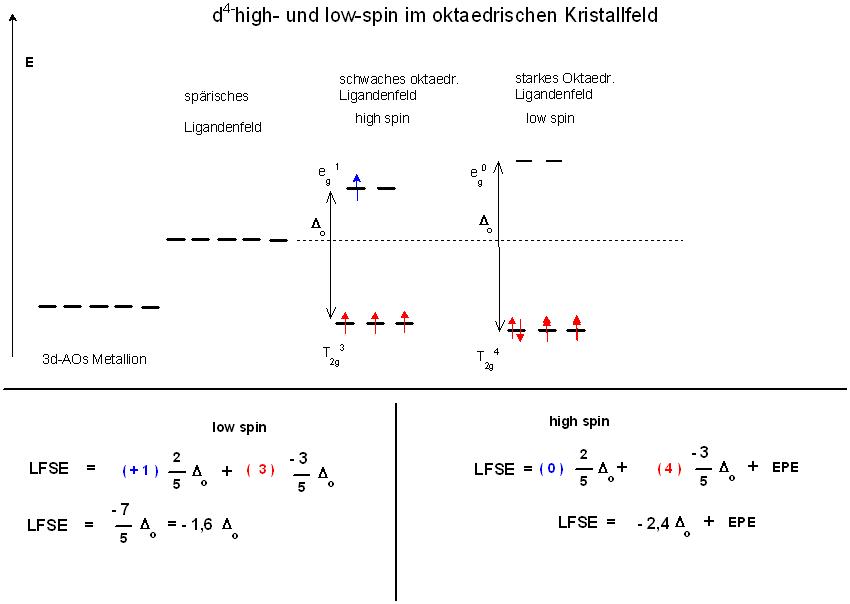
Beim oktaedrischen 3d4- high-spin-Komplex werden zunächst vier der fünf Orbitale gemäß der Hundt´schen Regel einfach besetzt. Die Elektronenpaarungs-Energie, EPE, ist im schwachen Ligandenfeld größer, als die Aufspaltung, Δo.
Die 3 Orbitale im energetisch tieferen Energie-Niveau sind dann jeweils einfach besetzt und eins der beiden Orbtale im höheren Energie-Niveau ist einfach besetzt.
Elektronen-Konfiguration: T2g 3 eg 1
Die Liganden-Feld-Stabilisierungs-Energie (LFSE) bei oktadrischer Koordination bei der High-Spin Orbitalbesetzung ergibt sich dann zu :
$$LFSE = \blue{1}\cdot \frac{2}{5}\cdot \Delta_{o} + - \red{3}\cdot \frac{3}{5}\cdot \Delta_{o}$$
$$LFSE = - \frac{7}{5}\cdot \Delta_{o} = - 1,6\cdot \Delta_{o}$$
(siehe Skizze)
Beim Low-Spn-Komplex mit starker Aufspaltung werden die drei energetisch tieferen Orbitale mit insgesamt 4 Elektronen besetzt.
Hierbei wird eins der der drei Orbitale doppelt aufgefüllt.
Hierbei muß be einer Doppelbesetzung eines Orbitals die Elektronen-Paarungs-Energie(EPE) aufgewendet werden.
Elektronenkonfiguration: T2g 4 eg 0
Kein Elektron im höchsten Energie-Niveau bedingt : 0 * 2⁄5 Δo = 0
4 Elektronen im untersten Energie-Niveau, bedingen: 4 * -3⁄5 Δo
Die Liganden-Feld-Stabilisierungs-Energie (LFSE) bei oktadrischer Koordination bei der Low-Spin Orbitalbesetzung ergibt sich dann zu :
$$LFSE = \blue{0}\cdot \frac{2}{5}\cdot \Delta_{o} + -( \red{4})\cdot \frac{3}{5}\cdot \Delta_{o} + \pink{1}\cdot EPE$$
$$LFSE = - \frac{12}{5}\cdot \Delta_{o} + \pink{1}\cdot EPE = - 2,4\cdot \Delta_{o} + EPE$$
(siehe Skizze)
Skizze