Grüße chemweazle,
Vielleicht hilft das ein wenig weiter.
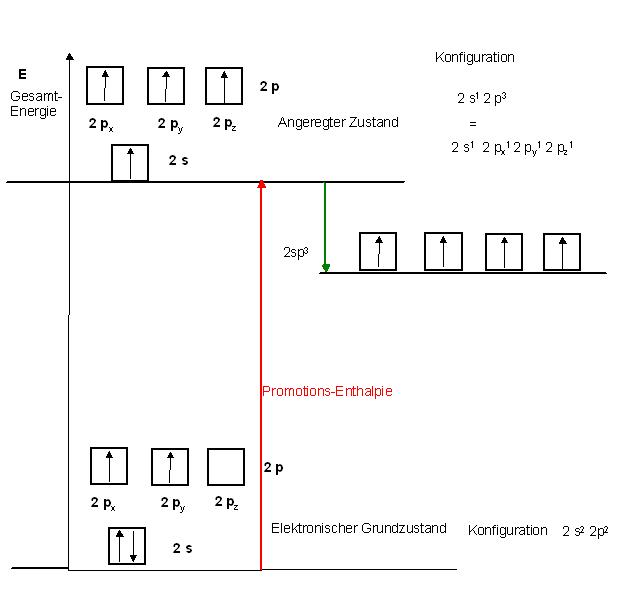
Kohlenstoffatom vom Grundzustand mit der Promotions-Enthalpie in den sehr energiereichen Zustand angeregt mit anschließender Energieabgabe in den Zustand mit den jeweils einfach besetzten vier sp3-Hybrid-Orbitalen
Grundzustand eines C-Atoms, die Schalenauffüllung erfolgt nach dem Aufbauprizip
2s2 2p2
Zuführung der Promotions-Enthalpie zu einem mol der C-Atome im Grundzustand führt zu 1 mol angeregter C-Atomen mit der Elektronenverteilung :
2s1 2p3 oder 2s1 2px1 2py1 2pz1
Nun sind alle drei 2p-Orbitale mit jeweils 1 Elektron besetzt und das 2s-Orbital mit 1 Elektron.
Unter Energie(Enthalpie-Freisetzung) gehen dann die C-Atome in der etwas energetisch günstigeren 2sp3-Zustand über, dieser ist aber energiereicher, als der Gundzustand.
siehe Skizze grüner Pfeil nach unten
Skizze