Grüße von chemweazle,
Bem.: Es ist richtig. Das prim. Amin, Anilin, Phenylamin wird am Stickstoff-Atom sulfoniert.
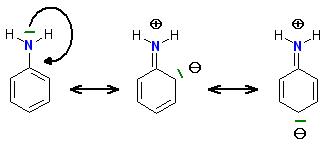
Aminogruppen, OH- , und SR-Gruppen erhöhen im Aromat die Elektronendichte durch den + M-Effekt, die Konjugation der freien Elektronenpaare mit dem Aromatischen &pi-System.
Skizze 1
Skizze 2
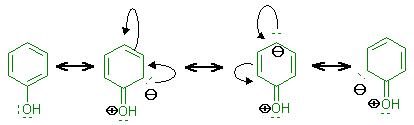
Aber die Elektronendichte ist an den freien Elektronenpaar(en) der NH2- OH-Gruppen, noch größer, als im Aromatischen π-System.
Deshalb greifen Elektrophile an dem Elektronenpaar der Aminogruppe, Hydroxylgruppe oder am Schwefelatom der SR-Gruppe an.
Skizze 3

Text erkannt:
Das Elektrophil greift am freien E-Paar der Amino- bzw. Hydroxylgruppe
Die Elektronendichte ist an diesen Stellen höher, als im Kern.
Das Elektrophil greift am freien E-Paar der Amino- bzw. Hydroxylgruppe
Die Elektronendichte ist an diesen Stellen höher, als im Kern.
Mit anderen Worten:
Also die Seitenkette hat in diesen Fällen die höhere Elektronendichte, als der Kern, deshalb erfolgt der Angriffs des Elektrophils an der Seitenkette.
Bei den Umsetzungen von Anilin, Phenylamin mit Sulfonsäurechloriden, Carbonsäurechloriden erfolgt die Aminolyse des Säurehalogenids.
Das Anilin verhält sich hier als prim. Amin, wie z.B. 1- oder 2-Propanamin.
Analog erfolgt bei den Umsetzungen von Phenol mit Sulfonsäurechloriden, Carbonsäurechloriden die Alkoholyse des Sulfonsäure- bzw. Carbonsäurehalogenids unter Bildung der Sulfonsäure-Phenylester bzw. der Carbonsäure-Phenylester.
Die Ladungsdichte ist am Stickstoffatom des Anilins am höchsten , auch beim Phenol ist Ladungsdichte an der OH-Gruppe am höchsten.
Ein Angriff eines Elektrophils erfolgt daher an der Aminogruppe des Phenylamins(Anilin) bzw. beim Phenol an der OH-Gruppe.
Also Anilin und Sulfonsäurechlorid ergibt das N-Phenyl-Sulfonsäureamid.
Mit Phenol bildet sich der entsprechende Sulfonsäure-Phenylester.
Bei der Amonolyse und bei der Alkoholyse von Sufonsäure- und Carbonsäurechloriden wird HCl-frei. Der freiwerdende Chlorwasserstoff verbraucht auch 1 Equivalent Anilin.
1 Eq. Sulfonsäurechlorid oder Carbonsäurchlorid reagieren mit 2 Eq. Anilin zu 1 Eq. Säureamid plus 1 Eq. Aniliniumchlorid.
Besser man verwendet zum HCl-Abfang Pyridin oder ein tert. Amin, z.B. Triethylamin, Tributylamin.
2 C
6H
5-NH
2 + Cl-SO
2-R → C
6H
5-NH-SO
2-R + C
6H
5-NH
3(+) + Cl
(-)
C6H5-NH2 + Cl-SO2-R + Et3N| → C6H5-NH-SO2-R + Et3NH(+) + Cl(-)
Bildung eines Sulfonsäure-Phenylesters durch Alkoholyse des Sulfonsäurechlorids
C6H5-OH + Cl-SO2-R + Et3N| → C6H5-O-SO2-R + Et3NH(+) + Cl(-)