Hallo liebe Leute,
ich habe Probleme bei dieser Aufgabe:
Betrachten Sie die exotherme Reaktion
$$ N i(s)+4 C O(g) \leftrightharpoons N i(C O)_{4}(g) $$
Bei geeigneten Bedingungen \( \left(\vartheta=100^{\circ} \mathrm{C}, p=1 \text { bar }\right) \) stellt sich ein Gleichgewicht zwischen Edukten und dem Produkt, Nickeltetracarbonyl, ein.
(a) Stellen Sie das Massenwirkungsgesetz für diese Reaktion auf.
(b) In welche Richtung verschiebt sich dieses Gleichgewicht mit Begründung, wenn Sie
i. die Temperatur auf \( 110^{\circ} \mathrm{C} \) erhöhen?
ii. den Druck auf 2 bar erhöhen?
iii. \( C O(g) \) z.B. durch Oxidation aus dem Reaktionsgemisch entfernen?
iv. einen geeigneten Katalysator hinzugeben?
(c) Wenn sie \( N i(s) \) und \( C O(g) \) bei \( \vartheta=40^{\circ} \mathrm{C} \) zusammen geben entsteht praktisch kein \( N i(C O)_{4}(g) \) obwohl die Gleichgewichtslage dies erwarten ließe. Warum?
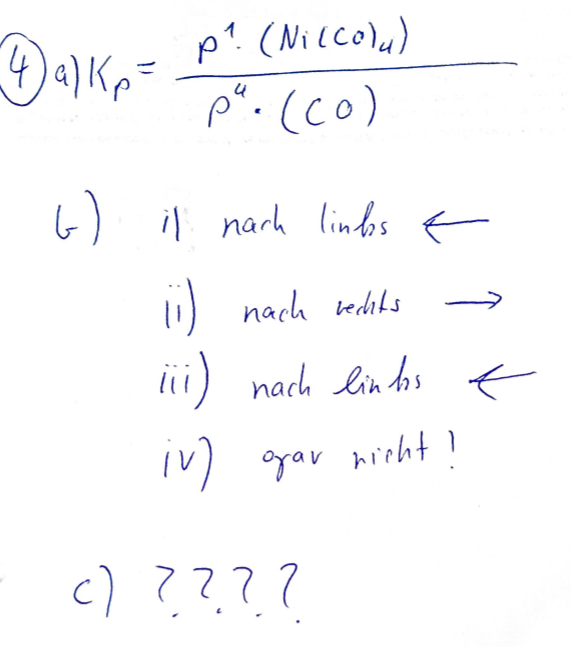
Text erkannt:
4) \( a \| K_{P}=\frac{P^{1} \cdot\left(N_{i}(C o)_{4}\right)}{\rho^{4} \cdot(C O)} \)
\( (-) \) il narh linfos \( \leftarrow \)
(1) nach rebls \( \rightarrow \)
iii) nach lin ths \( \leftarrow \)
iv? orar nirht?
\( c>72 ? \)
Bei c) habe ich gar keine Ahnung.
Freue mich auf Eure Hilfe.